गन्धकाम्ल
गन्धक का अम्ल (सल्फ्युरिक एसिड) एक तीव्र अकार्बनिक अम्ल है। प्राय: सभी आधुनिक उद्योगों में गन्धकाम्ल अत्यावश्यक होता है। अत: ऐसा माना जाता है कि किसी देश द्वारा गन्धकाम्ल का उपभोग उस देश के औद्योगीकरण का सूचक है। गन्धकाम्ल के विपुल उपभोगवाले देश अधिक समृद्ध माने जाते हैं।
| गन्धकाम्ल | |
|---|---|
 |
 |
| |

| |
| आईयूपीएसी नाम | सल्फ्युरिक अम्ल (गन्धकाम्ल) |
| अन्य नाम | 'ऑयल ऑफ विट्रोल' (Oil of vitriol) |
| पहचान आइडेन्टिफायर्स | |
| सी.ए.एस संख्या | [7664-93-9][CAS] |
| EC संख्या | |
| UN संख्या | 1830 |
| केईजीजी | D05963 |
| रासा.ई.बी.आई | 26836 |
| RTECS number | WS5600000 |
| SMILES | |
| InChI | |
| कैमस्पाइडर आई.डी | |
| गुण | |
| आण्विक सूत्र | H2SO4 |
| मोलर द्रव्यमान | 98.079 g/mol |
| दिखावट | Clear, colorless liquid |
| गंध | odorless |
| घनत्व | 1.84 g/cm3, liquid |
| गलनांक |
10 °C, 283 K, 50 °F |
| क्वथनांक |
337 °C, 610 K, 639 °F |
| जल में घुलनशीलता | miscible |
| वाष्प दबाव | 0.001 mmHg (20 °C)[1] |
| अम्लता (pKa) | −3, 1.99 |
| श्यानता | 26.7 cP (20 °C) |
| मानक मोलीय एन्ट्रॉपी S |
157 J·mol−1·K−1[2] |
| खतरा | |
| EU वर्गीकरण | |
| NFPA 704 | |
| R-फ्रेसेज़ | R35 |
| S-फ्रेसेज़ | (S1/2) S26 साँचा:S30 S45 |
| स्फुरांक (फ्लैश पॉइन्ट) | Non-flammable |
| यू.एस अनुज्ञेय अवस्थिति सीमा (पी.ई.एल) |
TWA 1 mg/m3[1] |
| एलडी५० | 2140 mg/kg (rat, oral)[5] |
| जहां दिया है वहां के अलावा, ये आंकड़े पदार्थ की मानक स्थिति (२५ °से, १०० कि.पा के अनुसार हैं। ज्ञानसन्दूक के संदर्भ | |
शुद्ध गन्धकाम्ल रंगहीन, गंधहीन, तेल जैसा भारी तरल पदार्थ है जो जल में हर परिमाण में विलेय है। इसका उपयोग प्रयोगशाला में प्रतिकारक के रूप में तथा अनेक रासायनिक उद्योगों में विभिन्न रासायनिक पदार्थों के संश्लेषण में होता है। बड़े पैमाने पर इसका उत्पादन करने के लिए सम्पर्क विधि का प्रयोग किया जाता है जिसमें गन्धक को वायु की उपस्थिति में जलाकर विभिन्न प्रतिकारकों से क्रिया कराई जाती है।
खनिज अम्लों में सबसे अधिक प्रयोग किया जाने वाला यह महत्त्वपूर्ण अम्ल है। प्राचीन काल में हराकसीस (फेरस सल्फेट) के द्वारा तैयार गन्धक द्विजारकिक गैस को जल में घोलकर इसे तैयार किया गया। यह तेल जैसा चिपचिपा होता है। इन्ही कारणों से प्राचीन काल में इसका नाम 'आयँल ऑफ विट्रिआँल' रखा गया था। हाइड्रोजन, गन्धक तथा जारक तीन तत्वों के परमाणुओं द्वारा गन्धकाम्ल के अणु का संश्लेषण होता है। आक्सीजन युक्ति होने के कारण इस अम्ल को 'आक्सी अम्ल' कहा जाता है। इसका अणुसूत्र H2SO4 है तथा अणु भार रसविद् आचार्यों को गन्धकाम्ल के संबंध में बहुत समय से पता था। उस समय हरे कसीस को गरम करने से यह अम्ल प्राप्त होता था। बाद में फिटकरी को तेज आँच पर गरम करने से भी यह अम्ल प्राप्त होने लगा। प्रारंभ में गन्धकाम्ल चूँकि हरे कसीस से प्राप्त होता था, अत: इसे "कसीस का तेल' कहा जाता था। तेल शब्द का प्रयोग इसलिए हुआ कि इस अम्ल का प्रकृत स्वरूप तेल सा है।
उपयोग
संपादित करेंगन्धकाम्ल का प्रयोग अनेक उद्योगों में होता है जिनमें से निम्नांकित प्रमुख हैं :
(१) उर्वरक उद्योग में, जैसे सुपरफास्फेट, अमोनियम सल्फेट आदि के निर्माण में,
(२) पेट्रोलियम तथा खनिज तेल के परिष्कार में,
(३) विस्फोटक पदार्थों के निर्माण में,
(४) कृत्रिम तंतुओं, जैसे रेयन तथा अन्य सूतों, के उत्पादन में,
(५) पेंट, वर्णक, रंजक इत्यादि के निर्माण में,
(६) फ़ॉस्फ़ोरस, हाइड्रोक्लोरिक अम्ल, नाइट्रिक अम्ल, धावन सोडा तथा अन्य रसायनकों के निर्माण में,
(७) इनैमल उद्योग, धातुओं पर जस्ता चढ़ाना तथा धातुकर्म उद्योगों में,
(८) बैटरी बनाने में (लेड एसिड बैटरी)
(९) ओषधियों के निर्माण में,
(१०) लौह एवं स्टील, प्लास्टिक तथा अन्य रासायनिक उद्योगों में।
(११) प्रयोगशालाओं में गन्धकाम्ल का प्रयोग विलायकों, निर्जलीकारकों (desiccating agent) तथा विश्लेषिक अभिकर्मकों के रूप में होता है।
गन्धकाम्ल इतने अधिक एवं विभिन्न उद्योगों में प्रयुक्त होता है कि उन सभी का उल्लेख यहाँ संभव नहीं है।
गुणधर्म
संपादित करेंभौतिक गुण
संपादित करेंगन्धकाम्ल एक प्रबल अम्ल है। इसका अणुसूत्र (H2SO4) है। यह रंगहीन तेल सदृश गाढ़ा द्रव होता है। शुद्ध अवस्था में २५° सें. ताप पर इसका घनत्व १.८३४ है। इसका हिमांक १०.५° सें. है।
गन्धकाम्ल का संरचना सूत्र सामान्यत: निम्नांकित रूप में लिखा जाता है :
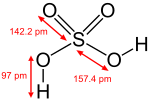
आधुनिक विचारधारा के अनुसार गन्धकाम्ल के अणु की संरचना चतुष्फलक (tetrahedron) होती है, जिसमें गंधक का एक परमाणु केंद्र में और दो हाड्रॉक्सी समूह तथा दो ऑक्सीजन के परमाणु चतुष्फलक के कोणों पर स्थित हैं। अम्ल के अणु की संरचना में गंधक-ऑक्सीजन बंध का अंतर १.५१ A (एंग्सट्रॉम इकाई) होता है।
ग्रेड
संपादित करें| Mass fraction H2SO4 |
घनत्व (kg/L) |
सान्द्रता (mol/L) |
सामान्य नाम |
|---|---|---|---|
| 10% | 1.07 | ~1 | तनु गन्धकाम्ल (dilute sulfuric acid) |
| 29–32% | 1.25–1.28 | 4.2–5 | लेड एसिड बैटरियों में प्रयुक्त |
| 62–70% | 1.52–1.60 | 9.6–11.5 | chamber acid उर्वरक अम्ल |
| 78–80% | 1.70–1.73 | 13.5–14 | tower acid ग्लोवर अम्ल (Glover acid) |
| 98% | 1.83 | ~18 | सान्द्र गन्धकाम्ल |
रासायनिक गुण
संपादित करेंगन्धकाम्ल जल के साथ मिलकर अनेक हाइड्रेट बनाता है, जिनमें सलफ़्यूरिक मोनोहाइड्रेट अपेक्षाकृत अधिक स्थायी होता है। इस गुण के कारण सांद्र गन्धकाम्ल उत्तम शुष्ककारक होता है। यह वायु से ही जल को नहीं खींचता वरन् कार्बनिक पदार्थों से भी जल का अंश खींच लेता है। जल के अवशोषण में अत्यधिक ऊष्मा का क्षेपण होता है, जिससे अम्ल का विलयन बहुत गरम हो जाता है। सांद्र गन्धकाम्ल प्रबल ऑक्सीकारक होता है। ऑक्सीजन के निकल जाने से यह सलफ़्यूरस अम्ल बनता है, जिससे गन्धक द्विजारकिक निकलता है। अनेक धातुओं पर गन्धकाम्ल की क्रिया से गन्धक द्विजारकिक प्राप्त होता है।
गन्धकाम्ल का जल में आयनीकरण होता है। इससे विलयन में हाइड्रोजन धनायन, बाइसल्फ़ेट तथा सल्फ़ेट ऋणायन बनते हैं। रासायनिक विश्लेषण की सामान्य रीतियों सेगन्धकाम्ल में गंधक, ऑक्सीजन तथा हाइड्रोजन की उपस्थिति जानी जा सकती है।
शत प्रतिशत शुद्ध गन्धकाम्ल का घनत्व १५° सें. पर १.८३८४ ग्राम प्रति मिलीलीटर होता है। गन्धकाम्ल को गरम करने से उससे गन्धक ट्राइऑक्साइड का वाष्प निकलने लगता है तथा अम्ल का २९०° सें. से क्वथन प्रारंभ हो जाता है। क्वथनांक में तब तक वृद्धि होती जाती है, जब तक ताप ३१७° सें. नहीं पहुंच जाता। इस ताप पर गन्धकाम्ल ९८.५४ प्रतिशत रह जाता है। उच्च ताप पर गन्धकाम्ल का विघटन शुरु हो जाता है और जैसे जैसे ताप ऊपर उठता है विघटन बढ़ता जाता है। सांद्र गन्धकाम्ल जल के साथ गन्धकाम्ल मोनोहाइड्रेट, गलनांक ८.४७° सें., गन्धकाम्ल डाइहाइड्रेट, गलनांक - ३९.४६° सें. तथा गन्धकाम्ल टेट्राहाइड्रेट, गलनांक - २८.२५° सें., बनाता है। जल के साथ क्रिया के फलस्वरूप प्रति ग्राम सांद्र अम्ल २०५ कैलोरी उष्म का उत्पादन करता है। सांद्र अम्ल कार्बनिक पदार्थों, लकड़ी तथा प्राणियों के ऊतकों से जल खींच लेता है, जिसके फलस्वरूप कार्बनिक पदार्थों का विघटन हो जाता है और अवशेष के रूप में कोयल रह जाता है। गन्धकाम्ल लवण बनाता है, जिसे सल्फ़ेट कहते हैं। सल्फ़ेट सामान्य या उदासीन लवण होते हैं, जैसे सामान्य सोडियम सल्फ़ेट (Na2SO4) या अम्लीय सोडियम बाइसल्फ़ेट (NaHSO4)। अम्लीय इसलिए कि इसमें अब भी एक हाइड्रोजन रहता है, जो क्षारकों से प्रतिस्थापित हो सकता है। धातुओं, धातुओं के ऑक्साइडों, हाइडॉक्साइडों, कार्बोनेटो या अन्य लवणों पर अम्ल की क्रिया से सल्फ़ेट बते हैं। अधिकांश सल्फेट जलविलेय होते हैं। केवल कैल्सियम, बेरियम, स्ट्रौंशियम और सीस के लवण जल में अविलेय या बहुत कम विलेय होते हैं। अनेक लवण औद्योगिक महत्व के हैं। बेरियम और सीस सल्फ़ेट वर्णक के रूप में, सोडियम सल्फ़ेट कागज निर्माण में, कॉपर सल्फ़ेट कीटनाशक के रूप में और कैल्सियम सल्फ़ेट प्लास्टर ऑव पैरिस के रूप में प्रयुक्त होते हैं। सीस और इस्पात पर सांद्र अम्ल की कोई क्रिया नहीं होती। अत: अम्ल के निर्माण में तथा अम्ल को रखने के लिए सीस तथा इस्पात के पात्र प्रयुक्त होते हैं।
निर्माण
संपादित करेंप्रयोगशाला विधियाँ
संपादित करेंप्रयोगशालाओं में निम्नांकित तीन रीतियों से अल्प मात्रा में गन्धकाम्ल तैयार किया जा सकता है :
(१) गन्धक ट्राइऑक्साइड को जल में घुलाने से,
(२) हाइड्रोजन परॉक्साइड तथा सल्फर डाइऑक्साइड की सीधी क्रिया से-
(३) वायु के संसर्ग में सल्फ़्यूरस अम्ल के विलयन के मंद ऑक्सीकरण से।
औद्योगिक उत्पादन
संपादित करेंऔद्योगिक स्तर पर सीस-कक्ष-विधि (lead chamber process) तथा संस्पर्श विधि (contact process) से अम्ल का उत्पादन होता है। संस्पर्श विधि में गन्धक अथवा आयरन सल्फ़ाइड सदृश किसी सल्फ़ाइड के दहन से सल्फर डाइऑक्साइड पहले बनता है और वह प्लैटिनम धातुयुक्त ऐसबेस्टस उत्प्रेरक की उपस्थिति में वायु के ऑक्सीजन द्वारा गन्धक ट्राइऑक्साइड में परिणत हो जाता है, जो जल में घुलकर गन्धकाम्ल बनता है।
सीस कक्ष विधि
संपादित करेंइस विधि में जल की उपस्थिति में नाइट्रिक अम्ल द्वारा सल्फर डाइऑक्साइड के ऑक्सीकरण से अम्ल बनता है। यह क्रिया-बड़े बड़े सीस कक्षों (लेड चैम्बर्स) में संपन्न होती है अत: इसका नाम 'सीस-कक्ष-विधि' पड़ा है। इस विधि का उपयोग भारी मात्रा में सल्फ्युरिक अम्ल बनाने के लिये होता था, किन्तु इसकी कुछ कमियाँ हैं जिसके कारण अब इसका स्थान संस्पर्श प्रक्रम ने ले लिया है।
बड़े पैमाने पर गन्धकाम्ल के निर्माण का पहला कारखाना १७४० ई. में लंदन के समीप रिचमंड में वार्ड नामक वैज्ञानिक द्वारा स्थापित किया गया था। निर्माण के लिए गंधक तथा शोरे के मिश्रण को लोहे के पात्र में गरम किया जाता था और अम्ल के वाष्प को काँच के पात्रों में जिनमें जल भरा रहता था, एकत्र किया जाता था। इस प्रकार से प्राप्त तनु अम्ल को बालु ऊष्मक के ऊपर काँच के पात्रों में सांद्र किया जाता था। कुछ समय पश्चात् शीघ्र टूटनेवाले काँच के पात्रों के स्थान पर छह फुट चौड़े सीस कक्षों का प्रयोग होने लगा। होल्केर नामक वैज्ञानिक के अयक परिश्रम द्वारा १८१० ई. में आधुनिक सीसकक्ष विधि का प्रयोग प्रारंभ हुआ। १८१८ ई. से गन्धक द्विजारकिक की प्राप्ति के लिए कच्चे माल गंधक के स्थान पर पाइराइटीज़ नामक खनिज का प्रयोग होने लगा। १८२७ ई. में गे-लुपैक स्तंभ तथा १८५९ ई. में ग्लोब्रर स्तंभ के विकास द्वारा सीस-कक्ष-विधि का आधुनिकीकरण हुआ। यहाँ नाइट्रोजन के ऑक्साइड, गन्धक द्विजारकिक तथा वायु को कक्ष में प्रवेश कराया जाता है। ऐसे गैस मिश्रण को २५ फुट ऊँचे ग्लोवर स्तंभ में नीचे से प्रवेश कराया जाता है। इस स्तंभ में ऊपर से गे-लुसैक स्तंभ का गन्धकाम्ल तथा नाइट्रोसिल गन्धकाम्ल का मिश्रण टपकता है। स्तंभ से निकलकर गैस मिश्रण सीस कक्ष में प्रवेश करता है। साधारणतया सीस कक्ष तीन रहते हैं। यहाँ कक्ष में भाप भी प्रवेश करता है। गैस मिश्रण और भाप के बीच क्रिया होकर, गन्धकाम्ल बनकर, कक्ष के पेंदे में इकट्ठा होता है। अवशिष्ट गैसे अब गे-लुसैक स्तंभ में प्रवेश करती हैं। इनमें प्रधानतया नाइट्रोजन के ऑक्साइड रहते हैं। गे-लुसैक स्तंभ कोक या पत्थर के टुकड़ों से भरा रहता है। उसमें ऊपर से गन्धकाम्ल टपकता है और रुकावट के कारण धीरे-धीरे गिरकर, नाइट्रोजन के ऑक्साइडों को अवशोषित कर, नाइट्रोसिल गन्धकाम्ल बनता है और ग्लोवर स्तंभ में प्रयुक्त होता है। इस प्रकार नाइट्रोजन के ऑक्साइडों की क्षति बचाई जाती है। सीस कक्ष से प्राप्त अम्ल अशुद्ध होता है। अशुद्धियों में आर्सोनिक, नाइट्रोजन के ऑक्साइड तथा कुछ लवण होते हैं। ऐसा अम्ल प्रधानतया उर्वरक के निर्माण में प्रयुक्त होता है। इसके लिए शुद्ध अम्ल आवश्यक नहीं है। ऐसा अम्ल सस्ता होता है।
संस्पर्श विधि
संपादित करेंगन्धक अम्ल निर्माण की दूसरे रीति संस्पर्श विधि है। इस विधि से प्राप्त अम्ल अधिक शुद्ध और सांद्र होता है। इसका विकास १८८९-९० ई. में नाइट्ज नामक वैज्ञानिक ने किया था। जर्मनी की बैडिश्चे एनिलिन एंड सोडा फैब्रिक कंपनी ने इस विधि से सर्वप्रथम अम्ल तैयार किया, अत: इसे बैडिश्चे विधि, अथवा बैडिश्चे प्रक्रम भी कहते हैं। संसार के अधिकांश गन्धकाम्ल का निर्माण आजकल संस्पर्श विधि से ही होता है। इससे किसी भी सांद्रण का अम्ल प्राप्त हो सकता है। इस विधि में गंधक को जलाकर, अथवा पाइराइटीज़ को उत्तप्त कर, गन्धक द्विजारकिक प्राप्त होता है। इसे वायु के साथ मिलाकर उत्प्रेरक पर ले लाया जाता है, जहाँ गन्धक द्विजारकिक वायु के ऑक्सीजन से संयुक्त होकर गन्धक ट्राइऑक्साइड बनता है। गन्धक ट्राइऑक्साइड को सांद्र गन्धकाम्ल में अवशोषित कराने से "ओलियम' प्राप्त होता है। ओलियम की जल के साथ क्रिया से वांछित सांद्रता के अम्ल को प्राप्त किया जाता है।
उत्प्रेरक के रूप में पहले सूक्ष्म विभाजित प्लैटिनम प्रयुक्त होता था। यह बहुत महँगा पड़ता था। जब प्लैटिनम के स्थान में वैनेडियम पेंटॉक्साइड प्रयुक्त होता है, जो प्लैटिनम की अपेक्षा बहुत सस्ता होता है। उत्प्रेरक की क्रियाशीलता कम न हो जाए, इसके लिए आवश्यक है कि सल्फर डाइऑक्साइड आर्सेनिक, राख तथा धूल कणों से बिल्कुल मुक्त हो। अत: गन्धक द्विजारकिक के छानने का प्रबंध रहता है और उसे ऐसे पदार्थों द्वारा पारित किया जाता है जिनमें आर्सेनिक पूर्णतया निकल जाए। यदि गैस को शुद्ध न कर लिया जाए, तो उत्प्रेरक की कार्यशीलता जल्द नष्ट हो सकती है। उत्प्रेरक कक्ष में जो गैसें प्रवेश करती हैं उनमें गन्धक द्विजारकिक, ऑक्सीजन और नाइट्रोजन रहते हैं। ऊर्ध्वाधर पात्रों में उत्प्रेरक रखा रहता है। वहाँ क्रिया संपन्न कर निकलती गैस को सांद्र गन्धकाम्ल में अवशोषित कराया जाता है। इससे ओलियम प्राप्त होता है। ओलियम में शत प्रति शत गन्धकाम्ल के अतिरिक्त ४० प्रतिशत तक अधिक गन्धक ट्राइऑक्साइड अवशोषित रह सकता है। आवश्यक मात्रा में पानी डालकर, इससे वांछित सांद्रता का अम्ल प्राप्त कर सकते हैं। संस्पर्श विधि से अम्ल निर्माण के अनेक संयंत्र बने हैं, जिनसे अधिक शुद्ध और कम खर्च में अम्ल प्राप्त हो सकता है। ऐसे संयंत्र अब बने हैं जिनमें २४ घंटे में ६०० टन अम्ल तैयार हो सके। इनकी देखभाल के लिए कुछ ही व्यक्ति पर्याप्त होते हैं। प्रति टन अम्ल के लिए एक टन से अधिक ऊँची दाब वाली संपृक्त भाप, या अति तप्त भाप, की आवश्यकता पड़ती है। प्रति टन १०० अम्ल की प्राप्ति के लिए ३५ किलोवाट बिजली और ४,००० गैलन ठंढे जल की आवश्यकता पड़ती है।
सन्दर्भ
संपादित करें- ↑ अ आ "NIOSH Pocket Guide to Chemical Hazards #0577". National Institute for Occupational Safety and Health (NIOSH).
- ↑ अ आ Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. पृ॰ A23. आई॰ऍस॰बी॰ऍन॰ 0-618-94690-X.
- ↑ "NuGenTec Material Safety Datasheet-Sulfuric acid" (PDF). मूल (PDF) से 15 फ़रवरी 2013 को पुरालेखित. अभिगमन तिथि 13 जनवरी 2016.
- ↑ "Sulfuric acid IPCS". मूल से 3 मार्च 2016 को पुरालेखित. अभिगमन तिथि 13 जनवरी 2016.
The substance is harmful to aquatic organisms.(ENVIRONMENTAL DATA)
- ↑ साँचा:IDLH
