जल
| इस लेख में सन्दर्भ या स्रोत नहीं दिया गया है। कृपया विश्वसनीय सन्दर्भ या स्रोत जोड़कर इस लेख में सुधार करें। स्रोतहीन सामग्री ज्ञानकोश के उपयुक्त नहीं है। इसे हटाया जा सकता है। स्रोत खोजें: "जल" – समाचार · अखबार पुरालेख · किताबें · विद्वान · जेस्टोर (JSTOR) |
| जल | |
|---|---|
 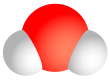
पानी सभी जीवों के लिए एक महत्वपूर्ण विलायक है | |
| सूचना एंव गुण | |
| साधारण नाम | जल, पानी नीर |
| IUPAC नाम | ऑक्सीडेन |
| वैकल्पिक नाम | एक्वा, डाईहाइड्रोजन मोनो ऑक्साइड, हाइड्रोजन हाइड्रॉक्साइड, (और) |
| अणु सूत्र | H2O |
| CAS संख्या | 7732-18-5 |
| InChI | InChI=1/H2O/h1H2 |
| मोलर द्रव्यमान | 18.0153 g/mol |
| घनत्व और रूप | 0.998 g/cm³ (द्रव 20 8°C पर, 1 atm) 0.917 g/cm³ (ठोस 0 8°C पर, 1 atm) |
| गलनांक | 0 °C (273.15 K) (32 °F) |
| क्वथनांक | 99.974 °C (373.124 K) (211.95 °F) |
| विशिष्ठ उष्मा क्षमता | 4.184 J/(g·K) (द्रव 20 °C पर) 74.539 J/ (mol·K) (द्रव 25 °C पर) |
| Supplementary data page | |
| Disclaimer and references | |
जल या पानी एक आम रासायनिक पदार्थ है जिसका अणु दो हाइड्रोजन परमाणु और एक ऑक्सीजन परमाणु से बना है - H2O। यह सारे प्राणियों के जीवन का आधार है। आमतौर पर जल शब्द का प्रयोग द्रव अवस्था के लिए उपयोग में लाया जाता है पर यह ठोस अवस्था (बर्फ) और गैसीय अवस्था (भाप या जल वाष्प) में भी पाया जाता है। पानी जल-आत्मीय सतहों पर तरल-क्रिस्टल के रूप में भी पाया जाता है।[1][2]
पृथ्वी का लगभग 71% सतह को 1.460 पीटा टन (पीटी) (1021 किलोग्राम) जल से आच्छदित है जो अधिकतर महासागरों और अन्य बड़े जल निकायों का हिस्सा होता है इसके अतिरिक्त, 1.6% भूमिगत जल एक्वीफर और 0.001% जल वाष्प और बादल (इनका गठन हवा में जल के निलंबित ठोस और द्रव कणों से होता है) के रूप में पाया जाता है।[3] खारे जल के महासागरों में पृथ्वी का कुल 97%, हिमनदों और ध्रुवीय बर्फ चोटिओं में 2.4% और अन्य स्रोतों जैसे नदियों, झीलों और तालाबों में 0.6% जल पाया जाता है। पृथ्वी पर जल की एक बहुत छोटी मात्रा, पानी की टंकिओं, जैविक निकायों, विनिर्मित उत्पादों के भीतर और खाद्य भंडार में निहित है। बर्फीली चोटिओं, हिमनद, एक्वीफर या झीलों का जल कई बार धरती पर जीवन के लिए साफ जल उपलब्ध कराता है।
जल लगातार एक चक्र में घूमता रहता है जिसे जलचक्र कहते है, इसमे वाष्पीकरण या ट्रांस्पिरेशन, वर्षा और बह कर सागर में पहुॅचना शामिल है। हवा जल वाष्प को स्थल के ऊपर उसी दर से उड़ा ले जाती है जिस गति से यह बहकर सागर में पहुंचता है लगभग 36 Tt (1012 किलोग्राम) प्रति वर्ष। भूमि पर 107 Tt वर्षा के अलावा, वाष्पीकरण 71 Tt प्रति वर्ष का अतिरिक्त योगदान देता है। साफ और ताजा पेयजल मानवीय और अन्य जीवन के लिए आवश्यक है, लेकिन दुनिया के कई भागों में खासकर विकासशील देशों में भयंकर जलसंकट है और अनुमान है कि 2025 तक विश्व की आधी जनसंख्या इस जलसंकट से दो-चार होगी।.[4] जल विश्व अर्थव्यवस्था में एक महत्वपूर्ण भूमिका निभाता है, क्योंकि यह रासायनिक पदार्थों की एक विस्तृत श्रृंखला के लिए विलायक के रूप में कार्य करता है और औद्योगिक प्रशीतन और परिवहन को सुगम बनाता है। मीठे जल की लगभग 70% मात्रा की खपत कृषि में होती है।[5]
पदार्थों में से है जो पृथ्वी पर प्राकृतिक रूप से सभी तीन अवस्थाओं में मिलते हैं। जल पृथ्वी पर कई अलग अलग रूपों में मिलता है: आसमान में जल वाष्प और बादल; समुद्र में समुद्री जल और कभी कभी हिमशैल; पहाड़ों में हिमनद और नदियां ; और तरल रूप में भूमि पर एक्वीफर के रूप में।
जल में कई पदार्थों को घोला जा सकता है जो इसे एक अलग स्वाद और गंध प्रदान करते है। वास्तव में, मानव और अन्य जानवरों समय के साथ एक दृष्टि विकसित हो गयी है जिसके माध्यम से वो जल के पीने को योग्यता का मूल्यांकन करने में सक्षम होते हैं और वह बहुत नमकीन या सड़ा हुआ जल नहीं पीते हैं। मनुष्य ठंडे से गुनगुना जल पीना पसंद करते हैं; ठंडे जल में रोगाणुओं की संख्या काफी कम होने की संभावना होती है। शुद्ध पानी H2O स्वाद में फीका होता है जबकि सोते (झरने) के पानी या लवणित जल (मिनरल वाटर) का स्वाद इनमे मिले खनिज लवणों के कारण होता है। सोते (झरने) के पानी या लवणित जल की गुणवत्ता से अभिप्राय इनमे विषैले तत्वों, प्रदूषकों और रोगाणुओं की अनुपस्थिति से होता है।
रसायनिक और भौतिक गुण
संपादित करें

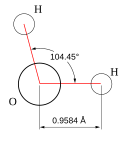
जल एक रसायनिक पदार्थ है जिसका रसायनिक सूत्र H2O है: जल के एक अणु में दो हाइड्रोजन के परमाणु सहसंयोजक बंध के द्वारा एक ऑक्सीजन के परमाणु से जुडे़ रहते हैं।
जल के प्रमुख रसायनिक और भौतिक गुण हैं:
जल सामान्य तापमान और दबाव में एक फीका, बिना गंध वाला तरल है। जल और बर्फ़ का रंग बहुत ही हल्के नीला होता है, हालांकि जल कम मात्रा में रंगहीन लगता है। बर्फ भी रंगहीन लगती है और जल वाष्प मूलतः एक गैस के रूप में अदृश्य होता है।[6]
- जल पारदर्शी होता है, इसलिए जलीय पौधे इसमे जीवित रह सकते हैं क्योंकि उन्हे सूर्य की रोशनी मिलती रहती है। केवल शक्तिशाली पराबैंगनी किरणों का ही कुछ हद तक यह अवशोषण कर पाता है।
ऑक्सीजन की वैद्युतऋणात्मकता हाइड्रोजन की तुलना में उच्च होती है जो जल को एक ध्रुवीय अणु बनाती है। ऑक्सीजन कुछ ऋणावेशित होती है, जबकि हाइड्रोजन कुछ धनावेशित होती है जो अणु को द्विध्रुवीय बनाती है। प्रत्येक अणु के विभिन्न द्विध्रुवों के बीच पारस्परिक संपर्क एक शुद्ध आकर्षण बल को जन्म देता है जो जल को उच्च पृष्ट तनाव प्रदान करता है।
- एक अन्य महत्वपूर्ण बल जिसके कारण जल अणु एक दूसरे से चिपक जाते हैं, हाइड्रोजन बंध है।[7]
- जल का क्वथनांक (और अन्य सभी तरल पदार्थ का भी) सीधे बैरोमीटर का दबाव से संबंधित होता है। उदाहरण के लिए, एवरेस्ट पर्वत के शीर्ष पर, जल 68 °C पर उबल जाता है जबकि समुद्रतल पर यह 100 °C होता है। इसके विपरीत गहरे समुद्र में भू-उष्मीय छिद्रों के निकट जल का तापमान सैकड़ों डिग्री तक पहुँच सकता है और इसके बावजूद यह द्रवावस्था में रहता है।
- जल का उच्च पृष्ठ तनाव, जल के अणुओं के बीच कमजोर अंतःक्रियाओं के कारण होता है (वान डर वाल्स बल) क्योंकि यह एक ध्रुवीय अणु है। पृष्ठ तनाव द्वारा उत्पन्न यह आभासी प्रत्यास्था (लोच), केशिका तरंगों को चलाती है।
- अपनी ध्रुवीय प्रकृति के कारण जल में उच्च आसंजक गुण भी होते है।
- केशिका क्रिया, जल को गुरुत्वाकर्षण से विपरीत दिशा में एक संकीर्ण नली में चढ़ने को कहते हैं। जल के इस गुण का प्रयोग सभी संवहनी पौधों द्वारा किया जाता है।
- जल एक बहुत प्रबल विलायक है, जिसे सर्व-विलायक भी कहा जाता है। वो पदार्थ जो जल में भलि भाँति घुल जाते है जैसे लवण, शर्करा, अम्ल, क्षार और कुछ गैसें विशेष रूप से ऑक्सीजन, कार्बन डाइऑक्साइड उन्हे हाइड्रोफिलिक (जल को प्यार करने वाले) कहा जाता है, जबकि दूसरी ओर जो पदार्थ अच्छी तरह से जल के साथ मिश्रण नहीं बना पाते है जैसे वसा और तेल, हाइड्रोफोबिक (जल से डरने वाले) कहलाते हैं।
- कोशिका के सभी प्रमुख घटक (प्रोटीन, डीएनए और बहुशर्कराइड) भी जल में घुल जाते हैं।
- शुद्ध जल की विद्युत चालकता कम होती है, लेकिन जब इसमे आयनिक पदार्थ सोडियम क्लोराइड मिला देते है तब यह आश्चर्यजनक रूप से बढ़ जाती है।
- अमोनिया के अलावा, जल की विशिष्ट उष्मा क्षमता किसी भी अन्य ज्ञात रसायन से अधिक होती है, साथ ही उच्च वाष्पीकरण ऊष्मा (40.65 kJ mol−1) भी होती है, यह दोनों इसके अणुओं के बीच व्यापक हाइड्रोजन बंधों का परिणाम है। जल के यह दो असामान्य गुण इसे तापमान में हुये उतार-चढ़ाव का बफ़रण कर पृथ्वी की जलवायु को नियमित करने पात्रता प्रदान करते हैं।
- जल का घनत्व अधिकतम 3.98 °C पर होता है।[8] जमने पर जल का घनत्व कम हो जाता है और यह इसका आयतन 9% बढ़ जाता है। यह गुण एक असामान्य घटना को जन्म देता जिसके कारण: बर्फ जल के ऊपर तैरती है और जल में रहने वाले जीव आंशिक रूप से जमे हुए एक तालाब के अंदर रह सकते हैं क्योंकि तालाब के तल पर जल का तापमान 4 °C के आसपास होता है।

- जल कई तरल पदार्थ के साथ मिश्रय होता है, जैसे इथेनॉल, सभी अनुपातों में यह एक एकल समरूप तरल बनाता है। दूसरी ओर, जल और तेल अमिश्रय होते हैं और मिलाने परत बनाते है और इन परतों में सबसे ऊपर वाली परत का घनत्व सबसे कम होता है। गैस के रूप में, जल वाष्प पूरी तरह हवा के साथ मिश्रय है।
- जल अन्य कई विलायकों के साथ एक एज़िओट्रोप बनाता है।
- जल को हाइड्रोजन और ऑक्सीजन में विद्युतपघटन द्वारा विभाजित किया जा सकता है।
- हाइड्रोजन की एक ऑक्साइड के रूप में, जब हाइड्रोजन या हाइड्रोजन-यौगिकों जलते हैं या ऑक्सीजन या ऑक्सीजन-यौगिकों के साथ प्रतिक्रिया करते हैं तब जल का सृजन होता है। जल एक ईंधन नहीं है। यह हाइड्रोजन के दहन का अंतिम उत्पाद है। जल को विद्युतपघटन द्वारा वापस हाइड्रोजन और ऑक्सीजन में विभाजन करने के लिए आवश्यक ऊर्जा, हाइड्रोजन और ऑक्सीजन को पुनर्संयोजन से उत्सर्जित ऊर्जा से अधिक होती है।
- वह तत्व जो हाइड्रोजन से अधिक वैद्युतधनात्मक (electropositive) होते हैं जैसे लिथियम, सोडियम, कैल्शियम, पोटेशियम और सीजयम, वो जल से हाइड्रोजन को विस्थापित कर हाइड्रोक्साइड (जलीयऑक्साइड) बनाते हैं। एक ज्वलनशील गैस होने के नाते, हाइड्रोजन का उत्सर्जन खतरनाक होता है और जल की इन वैद्युतधनात्मक तत्वों के साथ प्रतिक्रिया बहुत विस्फोटक होती है।
जल संसाधन
संपादित करेंऔर इसे भी देखें भारत के जल संसाधन
जल का उपयोग जब मानव करता है तो यह उसके लिये संसाधन हो जाता है। दैनिक कार्यों से लेकर कृषि में और विविध उद्द्योगों में जल का उपयोग होता है। जल मानव जीवन के लिये इतना महत्वपूर्ण संसाधन है कि यह मुहावरा ही प्रचलित है कि जल ही जीवन है।
जीवन पर प्रभाव
संपादित करेंजैविक दृष्टिकोण से, पानी में कई विशिष्ट गुण हैं जो जीवन के प्रसार के लिए महत्वपूर्ण हैं। यह कार्बनिक यौगिकों को उन तरीकों पर प्रतिक्रिया देने की अनुमति देता है जो अंततः प्रतिकृति की अनुमति देती है। जीवन के सभी ज्ञात रूप पानी पर निर्भर करते हैं। जल एक विलायक के रूप में दोनों महत्वपूर्ण है जिसमें शरीर के कई विलायकों को भंग किया जाता है और शरीर के भीतर कई चयापचय प्रक्रियाओं का एक अनिवार्य हिस्सा होता है।
पानी प्रकाश संश्लेषण और श्वसन के लिए मौलिक है। ऑक्सीजन से पानी के हाइड्रोजन को अलग करने के लिए प्रकाश संश्लेषक कोशिका सूर्य की ऊर्जा का उपयोग करते हैं। हाइड्रोजन CO2 (हवा या पानी से अवशोषित) के साथ मिलाकर ग्लूकोज और ऑक्सीजन को रिलीज करने के लिए जोड़ा जाता है। सभी जीवित कोशिकाओं ने इस तरह के ईंधन का उपयोग किया और सूर्य की ऊर्जा को प्राप्त करने के लिए हाइड्रोजन और कार्बन को ऑक्सीकरण, प्रक्रिया में पानी और CO2 (सेलुलर श्वसन) का उपयोग किया।
कृषि
संपादित करेंपानी का सबसे महत्वपूर्ण उपयोग कृषि में है, जो खाने के उत्पाद में महत्वपूर्ण है| कुछ विकासशील देशों ९०% पानी का उपयोग सिंचाई में होता है [9] और अधिक आर्थिक रूप से विकसित देशों में भी बहुत सारा उत्पाद होता है (जैसे अमरीका में, 30% ताजे मिठे जल का उपयोग सिंचाई के लिए होता है)।[10]
पचास साल पहले, आम धारणा यह थी कि पानी एक अनंत संसाधन था। उस समय, धरती पर इंसानों की संख्या आज के संख्या के आधे से भी काम था। लोग भी आज जितने आमिर नहीं थे और खाना, खास तौर पर, मांस कम खाते थे, इसलिए उनके भोजन का उत्पादन करने के लिए कम पानी की जरूरत थी उन्हें पानी की एक तिहाई आवश्यकता होती जो हम वर्तमान में नदियों से लेते हैं। आज, जल संसाधनों के लिए प्रतिस्पर्धा तीव्र है, जो "पीक पानी" की अवधारणा को जन्म देती है।[11] इसका कारण यह है कि अब इस ग्रह पर सात अरब लोग हैं, जल-प्यास मांस और सब्जियों की खपत बढ़ रही है, और उद्योग, शहरीकरण और जैव-ईंधन फसलों से पानी की बढ़ती प्रतिस्पर्धा है। भविष्य में, भोजन का उत्पादन करने के लिए और भी ज्यादा पानी की आवश्यकता होगी क्योंकि पृथ्वी की आबादी 2050 तक 9 अरब तक पहुंचने का अनुमान है। [12]
कृषि में जल प्रबंधन का मूल्यांकन 2007 में श्रीलंका में अंतर्राष्ट्रीय जल प्रबंधन संस्थान द्वारा किया गया था यह देखने के लिए कि दुनिया के बढ़ती आबादी के लिए भोजन उपलब्ध कराने के लिए पर्याप्त पानी है या नहीं। [13] इसने वैश्विक स्तर पर कृषि के लिए पानी की मौजूदा उपलब्धता का मूल्यांकन किया और पानी की कमी से पीड़ित स्थानों का नक्शा बनाया। यह पाया गया कि दुनिया में 1.2 अरब (बिलियन) से अधिक (कुल जान-संख्या का पांचवां हिस्सा) भौतिक पानी की कमी के क्षेत्र में रहता है , जहां सभी मांगों को पूरा करने के लिए पर्याप्त पानी नहीं है। एक और 1.6 अरब (बिलियन) लोग आर्थिक जल की कमी का सामना कर रहे इलाकों में रहते हैं, जहां पानी में निवेश की कमी या अपर्याप्त मानव क्षमता से अधिकारियों को पानी की मांग को पूरा करना असंभव बना देता है। रिपोर्ट में पाया गया कि भविष्य में आवश्यक भोजन का उत्पादन करना संभव होगा, लेकिन आज के खाद्य उत्पादन और पर्यावरण के रुझान को जारी रखने से दुनिया के कई हिस्सों में संकट पैदा हो जाएगा। वैश्विक जल संकट से बचने के लिए, किसानों को भोजन की बढ़ती मांगों को पूरा करने के लिए उत्पादकता बढ़ाने का प्रयास करना होगा, और उद्योगों और शहरों को पानी अधिक कुशलता से उपयोग करने के तरीके खोजने होंगे|[14]
कपास के उत्पादन के कारण भी पानी की कमी हुई है: १ किलोग्राम कपास - एक जींस पतलून के बराबर - उत्पाद करने के लिए 10.9 मीटर 3 पानी का उपयोग किया जाता है। जबकि कपास का उत्पादन दुनिया के 2.4% पानी ही उपयोग करता है,यह उपयोग उन क्षेत्रों में किया जाता है जो पहले से ही पानी की कमी के जोखिम में हैं। महत्वपूर्ण पर्यावरणीय नुकसान हुआ है, जैसे कि अराल सागर के लापता होना। [15]
जल चक्र
संपादित करें(वैज्ञानिक रूप से जल विज्ञान चक्र के रूप में जाना जाता है) जल, वायुमंडल, मिट्टी के पानी, सतह के पानी, भूजल और पौधों के बीच जल के निरंतर आदान-प्रदान को दर्शाता है। पानी इन चक्रों में से प्रत्येक के माध्यम से सख्ती से जल चक्र में निम्नलिखित स्थानांतरण प्रक्रियाओं को शामिल करता है: महासागरों और अन्य जल निकायों से हवा में वाष्पीकरण और भूमि के पौधों और जानवरों से हवा में प्रत्यारोपण। वर्षा से, हवा से घनीभूत वायु वाष्प से और पृथ्वी या सागर तक गिरने से। आम तौर पर समुद्र तक पहुंचने वाले देश से बहने वाला पानी
महासागरों पर अधिकांश जल वाष्प महासागरों में लौटता है, लेकिन हवाएं समुद्र में जल प्रवाह के रूप में उसी दर पर पानी की वाष्प लेती हैं, प्रति वर्ष लगभग 47 टीटी। भूमि के ऊपर, बाष्पीकरण और संवहन प्रति वर्ष एक और 72 टीटी का योगदान करते हैं। जमीन पर प्रति वर्ष 119 टन प्रति वर्ष की दर से वर्षा होती है, इसमें कई रूप होते हैं: सबसे अधिक बारिश, बर्फ, और ओलों, कोहरे और ओस से कुछ योगदान के साथ।ओस पानी की छोटी बूंद है जो पानी के वाष्प की एक उच्च घनत्व एक शांत सतह से मिलता है जब गाढ़ा रहे हैं ओस आम तौर पर सुबह में बना रहता है जब तापमान सबसे कम होता है, सूर्योदय से पहले और जब पृथ्वी की सतह का तापमान बढ़ना शुरू हो जाता है।
सन्दर्भ
संपादित करें- ↑ Henniker, J. C. (1949). "The Depth of the Surface Zone of a Liquid". Reviews of Modern Physics. Reviews of Modern Physics. 21 (2): 322–341. आइ॰एस॰एस॰एन॰ 0034-6861. डीओआइ:10.1103/RevModPhys.21.322.
- ↑ Pollack, Gerald. "Water Science". University of Washington, Pollack Laboratory. मूल से 15 फ़रवरी 2013 को पुरालेखित. अभिगमन तिथि 2011-02-05.
Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.
- ↑ Water Vapor in the Climate System Archived 2007-03-20 at the वेबैक मशीन, Special Report, [AGU], December 1995 (linked 4/2007). Vital Water Archived 2008-02-20 at the वेबैक मशीन UNEP.
- ↑ Kulshreshtha, S.N (1998). [Scholar?hl=en&lr=&ie=UTF-8&sa=G&oi=qs&q=%2210.1023+a+1007957229865%22+author:s-kulshreshtha "A Global Outlook for Water Resources to the Year 2025"] जाँचें
|url=मान (मदद). Water Resources Management. 12 (3): 167–184. डीओआइ:10.1023/A:1007957229865. अभिगमन तिथि 2008-06-09. - ↑ Baroni, L.; Cenci, L.; Tettamanti, M.; Berati, M. (2007). "Evaluating the environmental impact of various dietary patterns combined with different food production systems". European Journal of Clinical Nutrition. 61: 279–286. डीओआइ:10.1038/sj.ejcn.1602522.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Braun, Charles L.; Sergei N. Smirnov (1993). "Why is water blue?". J. Chem. Educ. 70 (8): 612. मूल (HTML) से 3 अप्रैल 2012 को पुरालेखित. अभिगमन तिथि 14 दिसंबर 2008.
- ↑ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. आई॰ऍस॰बी॰ऍन॰ 0-13-250882-6. मूल से 2 नवंबर 2014 को पुरालेखित. अभिगमन तिथि 25 दिसंबर 2008.
- ↑ Kotz, J. C., Treichel, P., & Weaver, G. C. (2005). Chemistry & Chemical Reactivity. Thomson Brooks/Cole.
- ↑ "WBCSD Water Facts & Trends". मूल से 1 March 2012 को पुरालेखित. अभिगमन तिथि 25 July 2010.
- ↑ Water Use in the United States, National Atlas.gov Archived 14 अगस्त 2009 at the वेबैक मशीन
- ↑ Gleick, P.H.; Palaniappan, M. (2010). "Peak Water" (PDF). Proceedings of the National Academy of Sciences. National Academy of Science. 107 (125): 11155–11162. डीओआइ:10.1073/pnas.1004812107. बिबकोड:2010PNAS..10711155G. मूल (PDF) से 8 नवंबर 2011 को पुरालेखित. अभिगमन तिथि 11 October 2011.
- ↑ United Nations Press Release POP/952 (13 March 2007). World population will increase by 2.5 billion by 2050 Archived 2009-07-28 at the वेबैक मशीन
- ↑ Molden, D. (Ed). Water for food, Water for life: A Comprehensive Assessment of Water Management in Agriculture. Earthscan/IWMI, 2007.
- ↑ Chartres, C. and Varma, S. (2010) Out of water. From Abundance to Scarcity and How to Solve the World's Water Problems. FT Press (US).
- ↑ waterfootprint.org/media/downloads/Report18.pdf
इन्हें भी देखें
संपादित करें- भारी जल
- कठोर जल
- आसुत जल
- शोधित जल (purified water)
- खनिजरहित जल (demineralised water)
- खनिज जल (mineral water)
- पेय जल
- लवणीय जल (या खारा जल)
बाहरी कड़ियाँ
संपादित करें- भारत का जल-पोर्टल
- जल प्रश्नोत्तरी (बच्चों का कोना; केन्द्रीय जल आयोग)